
深海微生物原位采样新技术及应用
文章来源:供稿/供图 高兆明 | 发布时间:2021-12-09 | 【打印】 【关闭】
深海是一个由高压和低温组成的极端环境,并存在热液、冷泉、泥火山、盐卤池等各种特殊生境。由于光线无法到达,深海生态系统被称为为以化能自养微生物为生命基础的“暗世界”。基于深海生物学研究在揭示生命起源与演化机制、解析全球碳氮元素循环过程以及寻找新的天然活性产物和工程酶类方面的重要意义和价值,越来越多科学研究人员将目光投向深海,并开展了一系列前沿性的深海探索项目。
作为海洋中最高丰度和生物量的生命形态,海洋微生物在碳、氮、硫等关键元素循环方面发挥重要作用,是生物地球化学循环过程中最重要的一员,因而成为海洋前沿科学研究的主要专注点之一。然而,受限于微生物培养技术条件的不足,实验室可培养的微生物种类非常有限,由于受压力、温度、原位物质能量特征等因素的影响深海来源的微生物更是难以培养。因此,对微生物的研究极度需要非培养依赖性的技术手段。目前,利用DGGE电泳、16S rRNA文库以及454焦磷酸法测序等手段,研究人员已对环境微生物的群落结构有了比较深入的认识。近年来高通量测序技术的快速发展更让科学家们得以从宏基因组学和宏转录组学水平解析环境微生物的功能特征。宏基因组学是从DNA水平上对环境微生物所携带的功能特征基因进行分析。宏转录组学则是从RNA水平上反应微生物的原位基因表达情况,可以更真实的揭示环境微生物的活性状态,日渐成为环境微生物学研究的发展趋势。
相对于DNA分子,RNA非常易于降解,其半衰期一般仅有几分钟(Steglich et al., 2010),这对如何获取真实反映微生物原位表达活性的转录组数据构成极大挑战。对于深海微生物取样而言,常规手段是通过Niskin取样瓶采集海水样品,将样品收回到船上后进行过滤收集和固定处理,这种取样方式存在诸多不足,从深海取样采集到回收至甲板上一般需耗时几十分钟至数小时不等,样品回收过程中压力、温度,及溶氧量等诸多环境因素的变化,将影响微生物的活性状态,致使获取的深海微生物样品无法真实反应其深海原位的基因表达情况。采用合适的装备,对深海样品进行原位富集过滤,并进行原位固定取样成为解决这一问题的关键。
在深海原位微生物取样技术方面,国外目前已经开展了相关的研发工作。其中,美国伍兹霍尔海洋研究所(WHOI)研发了拥有多个采样瓶的序列生物水体采样装置,可根据科学需求选择采集水体样本或是微生物样品,并能携带固定液完成样品的原位固定,实现原位样品序列采集功能。该实验装置已在大西洋中脊实验航次中,搭载于ROV深潜器进行了验证性实验(Breier et al., 2009)。2014年,该装置进行了系统升级,升级后的SUPR-V2系统功能更加全面(Breier et al., 2014)。Wurzbacher等人也设计开发了相对简单的原位过滤固定取样器(in situ filtration and fixation sampler, IFFS),用于分析水体中放线菌actR基因的原位表达情况。该装置配载脉冲触发装置,可在过滤给定体积的水样后(设计水样过虑体积为100ml-900ml) ,切换至固定液导管,实现对样品的原位固定(Wurzbacher et al., 2012)。Sanders等人则设计了原位生物组织匀浆固定取样器(in situ Mussel And Snail Homogenizer, ISMASH),通过搭载ROV深潜器,借助ROV机械手抓取热液区蜗牛后,可在海底放入该装置,进行原位的生物组织匀浆及样品保存,用于解析热液区贝类和螺类共生菌的转录组与共生机制(Sanders et al., 2013)。此外, McLane实验室作为一家专业科技公司(www.mclanelabs.com),服务于海洋科学研究,也根据客户需要量身设计了一系列的海洋水体取样装置,并且部分装置可搭载深海着陆器使用。不过,该公司的产品功能相对固化,对于特定需求(诸如高压力耐受性)需对装置做重新的设计调整。相对而言,国内对深海生物研究的起步较晚,技术积累相对缺乏。
因应深海科学研究的需求,中国科学院深海科学与技术研究所的科学及工程技术人员通力合作,设计了一套依托于着陆器的自动化深海微生物原位富集与固定取样器(ISMIFF)。该取样器是一套可在深海及深渊环境(深度大于6000的深海海域)下进行水体微生物原位富集过滤并将其生物信息即时固定的装置。本装置主要由控制舱和过滤舱两个舱体组成。其中,控制舱是一个充油补偿舱,包含控制电路板、泵、阀以及压力传感器等,过滤舱则主要用于放置生物滤膜。该装置搭载于着陆器进行作业,由着陆器提供能源,并通过串口与着陆器进行通讯。
ISMIFF的作业流程图1所示。作业开始前,需将装置内的管路清洗并充满无菌水。着陆器坐底后,为避开浮尘影响,延时0.5-2小时后向富集装置发送运行指令,富集装置控制泵开始运转,将海水泵入含有0.22 μm生物滤膜(用于截留微生物)的过滤舱中。装置内的压力传感器实时监控过滤管路中的液体压力,根据压力反馈控制泵的输出功率,从而使管路中液体压力保持在合理范围。当富集装置过滤海水体积达到预设置后,通过电磁阀切换试剂管路,将固定液注入过滤舱,以实现样品原位固定。着陆器回收后,立即在实验室进行滤膜样品的处理与保存。

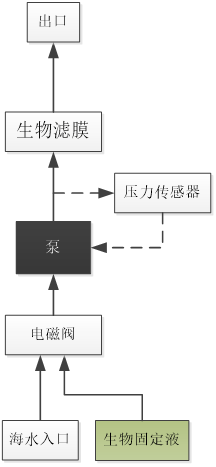
图1. 深海微生物原位富集与固定取样器及作业流程图
ISMIFF可最大程度实现原位保真取样。该取样器在过滤水体总量方面也具有明显优势,滤水初始流速高达700 ml/min,实际测试中7小时内完成约300L海水的原位过滤,远大于船载CTD采水器一次下作业的采水量240L,为在深海及深渊寡营养环境低丰度微生物样品的获取提供了便利。ISMIFF已完成121MPa(1万米海水深度1.2倍的压力值)的严格打压测试,可实现全海深原位取样,极大的扩展了装置的应用范围。
ISMIFF首先在中国科学院深海科学与工程研究所所执行的马里亚纳深渊科考航次中进行了实验性应用。科学家们采集了挑战者深渊序列深度的水体微生物原位样品,通过宏基因组测序对深渊原位条件下的水体微生物群落组成进行了解析,结果表明原位条件下的微生物群落组成与常规Niskin采水瓶采集的样品有很大差异(Wang et al. 2019)。基于新的基因组分拣技术,研究人员亦成功获取了30个深渊微生物类群的高质量基因组序列,阐明了与氮硫相关的元素循环过程和转录活性特征,并重点阐释了Chloroflexi和Marinimicrobia分别在深渊难降解型有机物和蛋白类有机物的代谢方面所发挥的重要作用(图2;Gao et al. 2019)。该研究是中国科学家首次对深渊微生物基因组进行较为全面的解析并对其原位代谢活性进行了详尽的报道,揭示出深渊特殊极端环境对微生物种群分化的驱动作用。另外,此研究还表明深渊特定微生物类群可能通过氧化CO来获取能量,拓展了CO氧化菌的已知生存空间范围(Gao et al. 2019)。

图2. 深渊水体微生物生态角色全面解析
在国家重点研发计划专项课题“冷泉系统生物演化及适应机制”(课题编号2018YFC0310005)的支持下,ISMIFF在海底冷泉微生物原位取样方面也实现了突破。在2019年5月及2020年5月广州海洋地质调查局“海洋地质六号”科考船的南海冷泉航次中,ISMIFF搭载“海马”号ROV,于海马冷泉区不同站位开展了底栖生物幼虫及水体微生物的富集和原位固定取样(图3)。在2021年1月,由中国科学院深海科学与工程研究所“探索二号”船执行的海南科考航次中,科学家们借助“深海勇士”号载人潜水器将ISMIFF直接布放海底,成功进行了多位点的原位固定取样(图4)。应用ISMIFF进行海底采样不仅能够大幅增加过滤水体的体积,减少工作量,而且可以实现样品原位固定,可以更好的服务于深海冷泉生态系统的科学研究。


图3. ISMIFF原位取样器借助“海马”号ROV在进行海底原位取样

图4. ISMIFF原位取样器直接布放于海底冷泉区进行原位取样
相关阅读:
Breier JA, Rauch CG, McCartney K, Toner BM, Fakra SC, et al. (2009). A suspended-particle rosette multi-sampler for discrete biogeochemical sampling in low-particle-density waters. Deep-Sea Res PT I, 56: 1579-1589.
Breier JA, Sheik CS, Gomez-Ibanez D, Sayre-McCord RT, Sanger R (2014). A large volume particulate and water multi-sampler with in situ preservation for microbial and biogeochemical studies. Deep-Sea Res PT I, 94: 195-206.
Gao ZM, Huang JM, Cui GJ, Li WL, Li J, Wei ZF, et al (2019). In situ meta-omic insights into the community compositions and ecological roles of hadal microbes in the Mariana Trench. Environ Microbiol, 21: 4092-4108.
Wurzbacher C, Salka I, Grossart HP. (2012). Environmental actinorhodopsin expression revealed by a new in situ filtration and fixation sampler. Environ Microbiol Rep, 4: 491-497.
Wang Y, Gao ZM, Li J, He LS, Cui G, et al. (2019). Hadal water sampling by in situ microbial filtration and fixation (ISMIFF) apparatus. Deep-Sea Res PT I, 144: 132-137.
Sanders JG, Beinart RA, Stewart FJ, Delong EF, Girguis PR. (2013). Metatranscriptomics reveal differences in in situ energy and nitrogen metabolism among hydrothermal vent snail symbionts. ISME J, 7: 1556-1567.

Copyright © 中国科学院深海科学与工程研究所 备案证号:琼ICP备13001552号-1
 琼公网安备 46020102000014号
琼公网安备 46020102000014号
地址: 三亚市鹿回头路28号 邮编:572000 网站维护:深海所办公室 邮箱:office@idsse.ac.cn